
遺伝子(核酸物質)を体内に投与することにより疾患を治療する方法。
現在大きく分けて二つの方法がある。
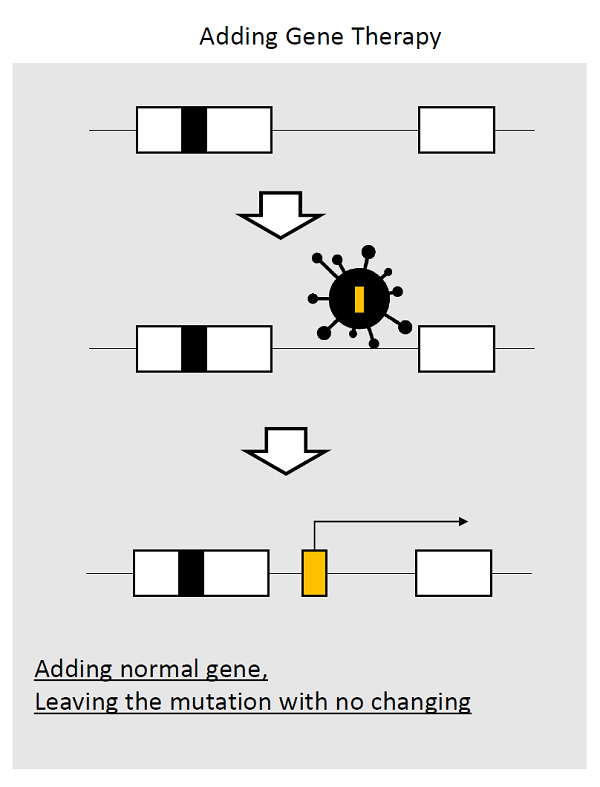
ウイルスベクターなどを用いて患者細胞の染色体上もしくは染色体外に正常遺伝子(図1、黄色部分)を導入し、酵素などの治療蛋白を発現させる方法。この場合、病因となっている遺伝子変異(図1、黒色部分)はそのままである。
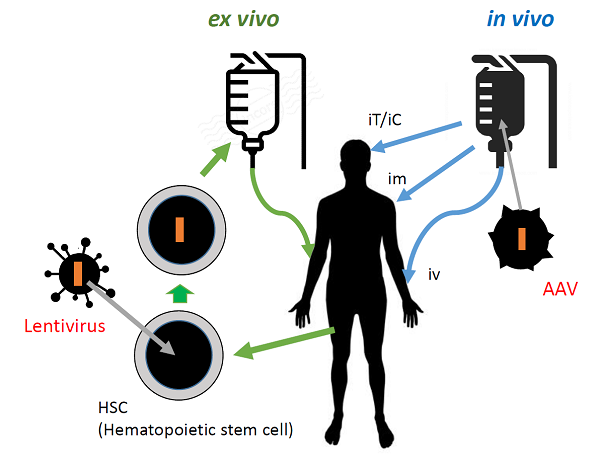
投与経路としてベクターを直接体内に投与(静注、髄腔内注、筋注等)するin vivo 法(図2、青色部分)と患者本人の造血幹細胞(Hematopoietic stem cell, HSC)等にベクターを用いて遺伝子導入し、その細胞を患者本人に静注して戻すex vivo法(図2、緑色部分)がある。前者はアデノ随伴ウイルス(adeno-associated virus, AAV)ベクター、後者はレンチウイルスベクターが主に用いられる。AAVは分裂細胞と静止状態の細胞の何れにも感染できる能力があり、広範な血清型それぞれに臓器指向性があり、遺伝物質を多様な細胞種に移送することが可能。近年では組換え型AAVは宿主ゲノムに挿入されないように改変され、染色体外で長期にわたり細胞内に存続する。ただし3.4kb以下の遺伝子しか組込めず、また患者が自然免疫で抗体を持っている血清型を投与すると生体から排除される。
レンチウイルスは逆転写酵素を用いて自身のRNAをDNAに変換して宿主のゲノムDNAに挿入、感染するレトロウイルスの一種。ヒト免疫不全ウイルス(HIV)などが知られ、ウイルスベクターとして用いると、分裂細胞だけでなく神経細胞や肝細胞などの非分裂細胞、幹細胞などマウス白血病ウイルスベクターといった従来のレトロウイルスベクターでは導入が難しい細胞も含めて、ほぼ全ての哺乳類細胞に効率よく遺伝子導入できる。また挿入変異に関する安全性もレトロウイルスベクターより高いとされている。なお現在白血病などの治療で用いられるCAR-T療法もex vivo法の一種だが、患者のHSCでなくT細胞を標的としてレンチウイルスで遺伝子導入し、細胞表面にCAR(Chimeric Antigen Receptor, キメラ抗原受容体)を発現させることでがん細胞表面に発現する特定抗原を認識し攻撃するようにした方法である。
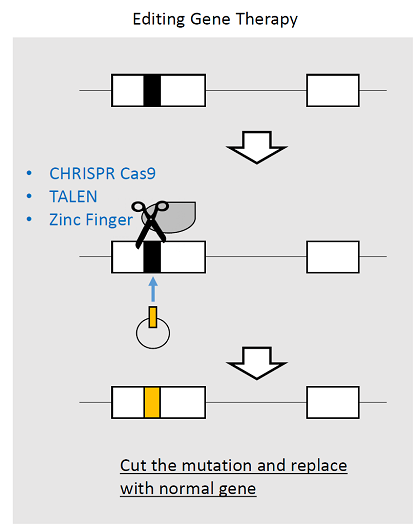
ヌクレアーゼと融合した人工キメラ蛋白などを用いて変異遺伝子そのもの(図3:黒色部分)を正常遺伝子(図3:黄色部分)に組替える方法。Zinc Finger, TALEN, CRISPR Cas9などの種類がある。
このうちCRISPR Cas9(図4)は細菌や古細菌など原核細胞におけるウイルス・ファージ等の遺伝的要素の侵入物を標的し排除するよう進化した適応免疫のシステムを応用し、DNA二本鎖を切断(Double Strand Breaks=DSBs)してゲノム配列の任意の場所を削除、置換、挿入することができる新しい遺伝子改変技術。 CRISPRはClustered Regularly Interspaced Short Palindromic Repeatsの略で、細菌などの原核生物でファージやプラスミドに対する獲得免疫機構として機能しているDNA領域。このシステムはカスタム化(標的遺伝子の変更や複数遺伝子のターゲット)が容易なことから、現在、哺乳類細胞ばかりではなく、細菌、寄生生物、ゼブラフィッシュなどの膨大な種類の細胞や生物種において、そのゲノム編集または修正に急速に利用されており、開発者エマニュエル・シャルパンティエ教授とジェニファー・ダウドナ教授は2020年度のノーベル化学賞を受賞している。
ただし臨床応用には、オフターゲット(標的部位以外の配列が切断・編集されてしまう)などの多くの課題がある。
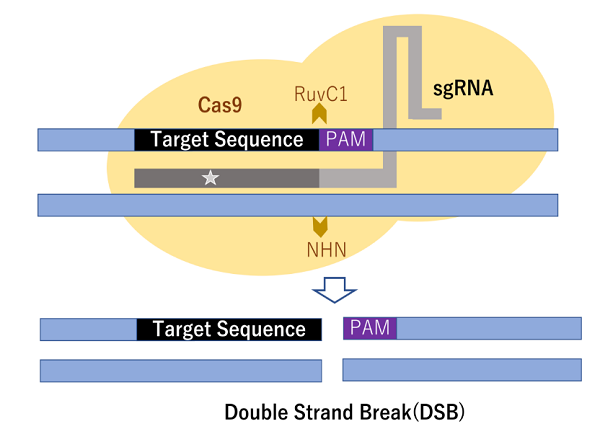
(図4)CRISPR/Cas9はエンドヌクレアーゼ(Cas9)とCRISPR配列由来の短鎖ガイドRNA(sgRNA)の複合体。 sgRNAの5‘末端20塩基(☆)はプロトスペーサー認識配列(PAM配列)の直前に位置するDNA部位を標的として認識し、Cas9に内在する2つのDNA切断ドメイン(RuvC1とNHN)でPAMの3-4塩基上流において二本鎖切断(DSB)を起こす。 DSBはその後、非相同性末端結合(NHEJ)と相同組換え型修復(HDR)のいずれかによって修復を受ける。
当研究部では主に難治性疾患の遺伝子治療を中心とした治療法の研究開発を行っている。
対象疾患は遺伝性疾患のうち特にライソゾーム病、および悪性腫瘍である。
主な研究対象を先天性代謝異常症に分類されるライソゾーム病(難病情報センター:指定難病19 )としている。ライソゾーム病とは細胞内小器官であるライソゾームに局在する水解酵素および膜輸送蛋白、活性化蛋白などの関連タンパク質の機能不全でその基質が細胞内蓄積することで様々な臓器障害を来す疾患であり、疾患によって症状は多岐にわたる。現在50種類以上知られ、その一部の疾患で酵素補充療法が保険収載されているが、中枢神経系、骨系統組織、心臓弁膜症などに対する効果には限界がある。また造血幹細胞移植も有効な根治療法とされるが、重篤な副作用やドナー確保などに課題がある。これらを克服する根治療法として遺伝子治療の開発に取り組んでおり、臨床実用化に向けて基礎研究を重ねている。
現在はレンチウイルス・アデノウイルス随伴ウイルス(AAV)などのウイルスベクターを用いた方法(遺伝子付加)が臨床試験の主流であり、我々も2017年からAMED難治性疾患実用化研究事業に採択され、「ムコ多糖症Ⅱ型の造血幹細胞を標的とした遺伝子治療の実用化研究」としてレンチウイルスベクターを用いたex vivo gene therapy に関してProof of concept (POC)の確立に成功した。引き続き2021年度より再生医療実用化研究事業に採択され、現在継続して非臨床試験・治験を目指し臨床開発を進めている。
参考:AMED再生・細胞医療・遺伝子治療研究開発2022(パンフレット)p.105
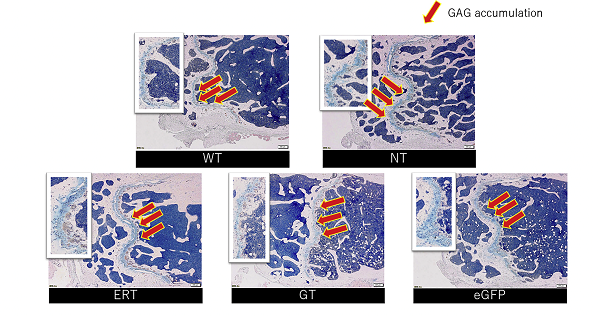
マウス大腿骨のAlcian Blue染色。ムコ多糖症II型における蓄積物質(GAG:赤矢印)がレンチウイルスベクターによる遺伝子治療により減少した。
WT:正常群、NT:無治療疾患群、ERT:酵素補充群、GT:遺伝子治療群、eGFP:治療コントロール群。(Wada et al. Mol Ther Methods Clin Dev. 2020 Dec 11; 19: 261–274. )
更にGM1ガングリオシドーシス、ファブリー病などの疾患の治療法開発に向けた基礎研究も進めつつある。また遺伝子編集として遺伝子自体を直接組替える技術(Zinc Finger, CRISPR Cas9など)の開発・基礎検討も行い、将来的には臨床応用の可能性を探る方針である。 なおライソゾーム病の根治療法として分子シャペロン誘導薬、プロテアソーム阻害剤などの従来の酵素補充療法を補完する低分子治療薬の開発研究も行っている。
消化器癌に対する遺伝子治療を主な研究対象として行っている
我々は、難治性消化器癌の増殖、浸潤、転移、または抗癌剤への耐性において転写因子NFκBの活性化が関与していることに着目し、現在までに膵臓癌、胆嚢癌、大腸癌の細胞株において、抗癌剤や放射線療法により活性化したNFκBを複数のNFκB阻害作用を持つ薬剤との併用や、遺伝子治療と組み合わせることで抗腫瘍効果を増強することをin vivo, in vitroにおいて示してきた。臨床の現場に於いても、切除不能膵臓癌に対するNFκB阻害作用を持つFUT175と塩酸ゲムシタビン(GEM)併用療法の第2相臨床試験が終了し、良好な成績を得る事が出来ている。
さらに膵癌肝転移モデルマウスにおいて、NFκB阻害時に変動するmiRNAを網羅的に解析した。肝転移の抑制に作用するmiRNAを同定することを目指し、研究を進めている。
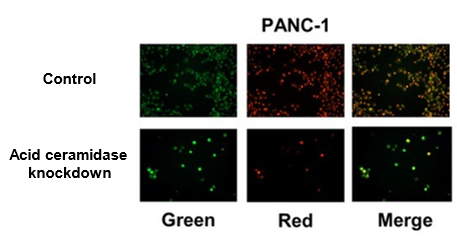
近年消化器癌における悪性度や進展にオートファジーの関係が示唆され、その抑制による抗腫瘍効果が示されている。本研究室では、オートファジーにおいて重要な役割を果たしているライソソームに着目し、消化器癌における新たな治療戦略としてライソゾームをターゲットとした新規遺伝子治療法の検討を行っている。これまで膵臓癌細胞株を用いて、各ライソゾーム酵素の阻害により細胞増殖能抑制効果を確認し、その原因が選択的分解機構であるマイトファジーに関与していることを突き止めた。
当研究部では以下の臨床研究を行っています。
私たちは東京慈恵会医科大学倫理委員会の承認を受け、平成23年(2011年)10月からファブリー病データベースを作成しています。なお現在この研究は、厚労省科学研究難治性疾患政策事業 調査研究班(奥山班)「ライソゾーム病、ペルオキシソーム病における良質かつ適切な医療の実現に向けた体制とその実装に関する研究」に参加しています。